
营养影响疾病的潜在分子机制
引言
人体约有50至70万亿个细胞,每个细胞都在高度复杂的生物系统网络中发挥着各自的功能[1]。DNA分子包含了机体各种功能所必需的信息,例如合成各种蛋白质、激素并完成各种及生化反应必需的分子等。DNA序列、结构的改变,以及DNA修复和维护机制的障碍,会导致包括癌症在内的多种健康风险[2]。因此,有助于维持基因组完整性和稳定性的机制,在预防包括癌症在内的疾病方面将发挥重要作用。免疫稳态为机体提供了另一个不可或缺的屏障,可抵御外在和内在的潜在致病因素。另外,创伤、感染及任何的组织损伤,均可导致机体发生免疫反应从而激活炎性过程。在细胞水平,炎症可促进受损组织的修复和愈合,防御诸如细菌和病毒的外来入侵,免疫监视有助于清除机体的癌前或恶变细胞。然而,持续的慢性炎症也可激活并破坏基因组的完整和稳定性,并促进癌前病变的发生。本文主要对营养在各种疾病中作用、潜在机制及病因学等进行相应阐述。
饮食对生存至关重要,同时,饮食的类型和进食量还会影响机体性和寿命,并对部分器官的健康和功能产生影响。
衰老
衰老的进程受基因和环境共同调控。端粒是染色体末端特殊的DNA-蛋白结构,端粒中DNA的长度随着细胞的每次分裂而缩短,当缩短到一定程度后,细胞进入遗传性衰老进程。因此,端粒的长度决定着机体的寿命,而随着细胞分裂而逐渐缩短的端粒是机体衰老的分子基础。然而,人类由端粒缩短速度决定着衰老的进程,并受基因、环境以及生活方式等因素影响。活性氧(reactive oxygen species,ROS),或称自由基,在调节生命的稳态和衰老的平衡方面发挥着重要作用,自由基可与DNA相互作用并导致DNA损伤,从而加速端粒缩短的进程[3]。干细胞能替换衰老和死亡的细胞,在维持整个生命的稳态和平衡中发挥重要作用。氧化应激在调节干细胞增殖、分化、自我更新和衰老等方面的功能已在学术界形成共识[4]。不同的饮食显著影响细胞内氧化应激水平,富含抗氧化剂的饮食可以通过保护DNA和端粒免受氧化损伤,从而减缓衰老速度。
神经系统
N-甲基-D-天冬氨酸受体(N-methyl-D-Aspartate glutamate receptors,NMDARs)是离子型谷氨酸受体的一个亚型,已知是受饮食影响的神经网络和认知功能重要的结构和功能单元。NMDRs是异质亚基,其组成与调节位点相关,效率受如丝氨酸消旋酶(serine racemase,SR)等酶类变构调节的影响[5]。SR是调节D-丝氨酸产生的重要调节因子,也是NMDARs的协同激动剂。SR的失调与精神和神经系统疾病有关,如抑郁症、肌萎缩侧索硬化症和精神分裂症等[5]。有研究表明,富含ω-3多不饱和脂肪酸的饮食可大幅逆转大鼠前脑谷氨酸受体随年龄增长而下降的趋势[6],八周的改良喂养逆转了长时程增强和去极化诱导的谷氨酸递质释放的年龄相关损害[6]。富含ω-3多不饱和脂肪酸的饮食可逆转老年大鼠海马神经元膜中的两种主要多不饱和脂肪酸:22-碳六烯酸和花生四烯酸含量的降低[7]。同样,常规疗法对原发性脑肿瘤中的胶质母细胞瘤疗效一般,患者的预期寿命为8到15个月不等。同样,生酮饮食(ketogenic diet,KD)至少在动物模型水平上表现出了有一定前景的结果[8]。值得注意的是,由于样本量小,研究数量有限,尚无法准确判断KD对胶质母细胞瘤的确切疗效[8]。KD的特征是低碳水化合物高脂肪饮食,而脑瘤细胞可利用的唯一能量来源是葡萄糖,所以葡萄糖代谢可能是治疗原发性脑肿瘤的潜在靶点[8]。阿尔茨海默病(Alzheimer’s disease,AD)和帕金森氏病(Parkinson’s disease,PD)分列神经退行性疾病的第一和第二位[9]。全球700~1000万人罹患PD,其病理生理机制尚未完全阐明,由ROS过度产生引起的氧化应激增加,是被广泛接受的致病因素之一。ROS对脂质、蛋白质和DNA造成氧化损伤,进而导致神经变性。通过饮食调节ROS的产生可能是应对PD的策略之一[9]。
肝脏
肝性脑病(hepatic encephalopathy,HE)是一种慢性肝脏疾病导致的神经系统并发症,包括不同程度的认知和运动障碍。氨诱导的星形胶质细胞衰老涉及GADD45α和p53的激活、细胞周期抑制因子的水平升高以及谷氨酰胺合成依赖性的ROS形成[10]。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的90%以上,也是癌症相关死亡的第三大原因[11]。肝硬化是HCC患者最重要的危险因素(70%~90%)[12]。肝癌发生最相关的危险因素是慢性乙型和丙型病毒性肝炎。除病毒性肝炎外,脂肪肝还与饮食及营养因素密切相关,在工业化国家表现尤甚。此外有研究表明,酒精滥用是发生HCC和肝硬化的重要危险因素之一[13],但咖啡消耗与HCC风险呈负相关[14-18]。一项荟萃分析显示,咖啡消耗使得HCC的风险下降40%[19]。与红肉相比,白肉和鱼的饱和脂肪酸和胆固醇较少,且富含多不饱和脂肪酸 (poly-unsaturated fatty acid,PUFA),其中n-3 PUFA通过抑制肿瘤坏死因子(tumor necrosis factor,TNF)和白介素1(interleukin-1,IL-1)的合成,发挥抗炎活性[20]。体外研究表明,n-3 PUFA可通过阻断环加氧酶2和β-连接素信号通路,抑制HCC进展[21]。
营养物质对重要细胞进程的帮助作用
人体内的重要生化反应均需要一定的物质基础。因营养为这些物质基础提供能量和原材料,所以饮食种类在重要细胞进程中起着关键作用。例如,维生素A是眼睛健康的重要营养元素,而钙对骨骼强度至关重要,DNA的合成需要足够量的维生素B3、B12和叶酸,上述维生素的缺乏会导致DNA合成障碍,从而影响基因组的完整性和稳定性[22]。微量元素锌对于DNA锌指结构的形成至关重要[23],而硒则可作为某些肿瘤抑制基因的组成部分发挥抗癌作用(图1)[24,25]。叶酸的缺乏与包括遗传性损伤、早衰、心脏病和某些癌症在内的许多疾病相关[26]。维生素D缺乏除可能导致骨质疏松症外,还与癌症[27]、糖尿病[28,29]以及多发性硬化症[30]等疾病相关。
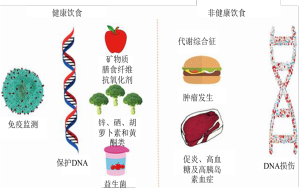
饮食因素对炎症、DNA损伤及完整性的影响
基因的正常活动受到干扰时,将导致DNA受损,包括自由基、DNA复制错误和转录错误,衰老和皮肤皱纹的产生均是DNA损伤的迹象。不同器官DNA损伤的速度不同,并导致疾病风险的增加[31,32]。
自由基等不稳定分子是造成衰老和DNA损伤的重要原因,自由基是机体生化反应的副产物,如消化食物、感染以及有害化学物质的解毒等过程。香烟烟雾、汽车尾气、复印机烟雾和一些其他废气污染物、紫外线辐射以及X射线等,也是自由基产生的原因。人体的每个细胞可产生数千个自由基,平均在27岁即可出现自由基产生的损害。随着自由基数量的增加,它们会在DNA的不同位置积累,吸烟导致的DNA突变在肺部较多见[33,34]。
线粒体主要依赖于核基因组的氧化磷酸化系统(oxidative phosphorylation system,OXPHOS),也通过线粒体DNA(mitochondrial DNA,mtDNA)完成细胞器的增殖及清除[35]。DNA发生损伤后会触发不同的异常,如线粒体自噬、DNA修复丧失障碍、组织病理学以及其他退行性感染等的发生[36]。线粒体基因组的损伤,会导致DNA的稳定性改变以及完整性受损。因此,维持mtDNA的完整性是机体健康的基础,营养可能在维持mtDNA完整性及延长预期寿命等方面发挥关键作用。
营养不良和DNA损伤
饥饿和营养不良仍是一些国家目前面临的严峻挑战之一,全球近30%的人遭受一种或多种形式的饥饿[37]。营养不良可导致包括死亡、残疾和身心发育迟缓等灾难性后果。发达国家儿童每年死亡1 090万人,约有60%被认为是缺乏健康的食物引起的[38]。营养不良的根本原因在于贫穷和不平等,而通过营养规划来消除营养不良,则需要政治和社会的同步行动。各种食品补充剂可以消减健康状况不良并减少疾病的发生[39]。
饮食和基因组不稳定性之间的关联提示各种饮食因素对疾病的预防作用。DNA损伤、表观基因组和染色体水平是发育和退行性疾病的根本原因,数百个基因通过错综复杂的机制维持基因组的完整性[40]。参与DNA翻译、DNA修复以及遗传毒素解毒的蛋白质依赖于饮食中辅助因子发挥最佳功能[41]。DNA损伤的生物标志物,可用于诊断因微量营养素缺乏导致的基因组不稳定,并且可通过优化营养状况的干预策略来降低基因组和表观基因组损伤率[42]。
叶酸、B族维生素及其他无机元素与DNA的合成和修复
微量营养物质(维生素和矿物质),作为与DNA合成和修复相关蛋白质的辅助因子,可改善DNA的氧化损伤。任何包括叶酸、B族维生素以及铁、锌等矿物质在内的微量营养素缺乏都会导致细胞毒性损伤或氧化损伤。这些微量营养物质的缺乏,将导致DNA损伤、肿瘤发生以及其他退行性疾病[43]。缺乏叶酸会导致尿嘧啶累积到DNA中,诱导染色体断裂,这种染色体断裂是人类癌症的潜在致病因素。叶酸缺乏可能是急性淋巴细胞白血病的主要原因,补充叶酸可逆转DNA中高水平的尿嘧啶以及染色体断裂[44]。与叶酸缺乏症一样,维生素B12的缺乏同样会导致DNA中尿嘧啶的累积和染色体断裂,维生素B12补充剂对于限制染色体断裂非常重要[45]。维生素B6不足可通过染色体断裂导致卒中和动脉粥样硬化,维生素B6补充剂可降低这些风险[46]。
烟酸(维生素B3)通过维持烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的含量促进DNA断裂的修复,从而维持ploy-ADP核糖反应,以应对DNA损伤[47]。烟酸的缺乏会损害DNA的修复,因此叶酸及抗氧化剂的缺乏会协同促进DNA损伤并导致肿瘤[48]。硒在预防癌症方面起着重要作用[49],缺锌是食道癌的病因之一,二者缺乏的结果最终导致DNA的氧化损伤和断裂,以及染色体的损伤的增加[50]。
肥胖、骨关节炎和代谢综合症
生活方式的改变及有害环境的暴露是代谢综合征的主要因素。此外,与炎症、血脂异常、胰岛素抵抗、糖尿病及心血管疾病风险增加相关的肥胖和代谢综合征也受到遗传易感性的影响[51]。这些代谢因素可能会增加肥胖诱发的骨关节炎风险[52]。肥胖主要由营养过剩和久坐的生活方式引起,持续性肥胖会使代谢失去控制,严重影响血糖、血压和血脂的调节,并导致代谢综合征[53]。肥胖同时也是骨关节炎的危险因素之一,通过不同的收敛机制导致软骨破坏,脂肪细胞可以产生大量脂肪因子,均在骨关节炎的发展和进展中起着关键作用[54]。
Popkin和Doak[55]报告称,过去十年中几个发达国家的肥胖患病率从2.3%上升到19.6%,中东、太平洋岛国、澳大利亚和中国的肥胖率自1980年代以来均在持续上升[56]。在政府和立法工作的支持下,由个人和社区倡议组成的各种健康策略,将有助于最大限度地减少发展中国家的肥胖和代谢紊乱发病率。
营养不良、炎症和免疫缺陷
细胞遭受微生物感染后,通过包括Toll样受体(Toll-like receptor,TLRs)、RIG样受体(RIG like receptors,RLRs)、NOD样受体(NOD like receptors,NLRs)和C型凝集素受体(C-type lectin receptors,CLRs)在内的先天模式识别受体(pattern recognition receptors,PRRs)介导激活细胞内信号级联反应以消除病原体和受感染的细胞。然而,该系统会因自身免疫和免疫缺陷诱导而被异常激活[57]。
免疫缺陷指免疫系统对抗感染性疾病和癌症的能力受损或完全丧失的状态。免疫缺陷由包括淋巴细胞、吞噬细胞和补体系统在内的免疫系统组分或功能缺乏导致。免疫缺陷可以是像布鲁顿病(X-染色体连锁的无丙种球蛋白血症)这样的原发疾病,也可以是由HIV感染引起的继发性疾病。原发性免疫缺陷病是由包括T细胞、吞噬细胞和补体成分在内的免疫内在缺陷引起的,如细胞外细菌引起复发性肺炎的原因是缺乏抗体,T淋巴细胞的缺乏可导致反复发作的真菌感染[58]。继发性免疫缺陷可能是由影响T和B淋巴细胞功能的药物引起,最常见的继发性免疫缺陷是由HIV感染导致的获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)。AIDS主要通过影响CD4+ T细胞导致细胞免疫反应减弱,从而产生恶性感染及癌症[59]。大多数免疫缺陷是先天性的X连锁常染色体隐性遗传性疾病,如免疫缺陷伴共济失调-毛细血管扩张症是由编码DNA修复酶的基因突变引起的常染色体隐性疾病,缺陷是由第14号染色体上T细胞受体(T-cell receptor,TCR)和免疫球蛋白重链基因座的分裂引起的[60]。
营养不良是继发性免疫缺陷的原因,如蛋白质营养不良会影响细胞免疫,虽然吞噬功能正常,但吞噬细胞杀死细胞内微生物的能力受损。营养不足可能导致癌症、慢性肾脏疾病、多发性损伤和慢性感染。缺锌和缺铁对免疫有多种影响,包括皮肤发生超敏反应的延迟。
维生素B6、B12、硒和铜对免疫系统也很重要。目前认为,氧化应激与所有炎症性疾病(关节炎症、血管炎、肾小球肾炎和成人呼吸系统疾病)、缺血性疾病、艾滋病、肺气肿、器官移植、胃溃疡、高血压、神经系统疾病(阿尔茨海默病、帕金森病、肌肉萎缩症)等均相关[61]。氧化应激的发生是由抗氧化防御和自由基产生之间失衡导致的,体内ROS的增加可以改变DNA结构,导致蛋白质和脂质的修饰,诱导转录因子的激活,产生促炎和抗炎细胞因子[62]。抗氧化剂可通过直接清除ROS并抑制细胞增殖来降低氧化应激,β-胡萝卜素可以防止紫外线致癌,并通过改变致癌物的肝脏代谢发挥抗癌作用[63]。
维生素C有助于预防癌症,通过其抗氧化特性,阻断亚硝胺的形成,增强免疫反应,加速肝脏的解毒过程[64]。维生素E作为抗氧化剂,具有促进抗体和TNF产生、增强细胞免疫、抗细菌感染、抑制诱变物的形成、修复细胞膜等功能,可通过增强免疫系统来防止肿瘤发生和抑制癌变[65]。因此,营养可能有助于将炎症反应扩展到机体接触的病原体、毒素和组织损伤的边界。维生素、抗氧化剂、植物类黄酮和益生菌等膳食成分都有可能改变慢性炎症的易感性,并起到治疗作用。
不同类型的营养物质对DNA的影响性能也各异,锌、叶酸、维生素D、类黄酮和类胡萝卜素等影响DNA健康,维生素A影响细胞的生长和分化,B族维生素参与DNA的修复、合成和调节,包括维生素C、D和E在内的其他重要的维生素以及包括锌、铬和硒在内的矿物质对DNA的健康均很重要[66,67]。
膳食补充剂对癌症的作用
许多基因为原癌基因,可以通过各种机制被抑制,p53基因是抑癌基因之一,被激活后可发挥抑癌作用,目前已在50多种癌症中发现p53基因突变。其他相关因素包括叶酸和硒,均有助于维持p53基因的正常功能及遗传稳定性。另一种编码谷胱甘肽-S-转移酶的基因GST,其编码产物作为抗氧化剂,使得细胞免受自由基和其他有害化学物的损害,从而参与了癌症的预防。维生素D受体(Vitamin D Receptor,VDR)基因多态性与乳腺癌、前列腺癌和结肠癌的风险增加有关[68-70]。
癌症在某种程度上可以通过多种生活方式和营养补充剂来控制。蔬菜和水果是大多数癌症的低风险来源,草药富含抗氧化剂,有助于减缓DNA损伤;另一种强大的抗氧化剂谷胱甘肽过氧化物酶,其构成中的重要成分是硒,可保护DNA免受自由基的损害。天然琥珀酸是维生素E的一种形式,具有强大的抗癌作用[71]。DNA修复过程和原癌基因的抑制受维生素B6和B12维持。辅酶Q10是一种类似维生素的营养物质,同样也是一种保护性的抗氧化剂,能增强免疫细胞的活性以对抗癌细胞[72]。对于癌症的治疗,可使用大量的维生素及矿物质与其他传统医学疗法相结合,如宫颈癌可通过使用维生素E、辅酶Q10、维生素C、β-胡萝卜素和维生素A结合药物治疗得到治疗。这些营养物质不会对肿瘤产生直接影响,但是可以通过增强患者免疫系统功能来对抗癌细胞[73]。
结论
膳食中的天然抗氧化剂在影响疾病进展的多种代谢途径中发挥着重要作用。植物性饮食,水果和蔬菜,富含纤维、抗氧化剂和健康的脂肪酸,可以降低疾病的风险。水果和蔬菜中的许多物质在本质上对生物系统都具有保护作用。保护效应不太可能是由单一功能的植物化学物质或营养物质所决定的。
均衡饮食的成分,如生物活性化合物,可以重新调节基因的表达。根据个人的遗传特征,营养摄入对降低疾病发病风险具有重要作用。营养遗传学/基因组学可以用来指导患者的个性化饮食。一些研究已经报道了所有疾病的代谢改变,包括肿瘤症患者能量物质的高消耗以及ROS产率的增加等。在生物系统中,食物分子作为配体可靶向细胞内外的多种潜在靶点以对抗疾病。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Masood A. Shammas, Pierfrancesco Tassone and Bisweswar Nandi) for the Series “Genomic Instability, Clonal Evolution and Oncogenesis” published in Precision Cancer Medicine. The article was sent for external peer review organized by the Guest Editors and the editorial office.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/pcm.2020.02.01). The Series “Genomic Instability, Clonal Evolution and Oncogenesis” was commissioned by the editorial office without any funding or sponsorship. The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Brook AH, O'Donnell MB, Hone A, et al. General and craniofacial development are complex adaptive processes influenced by diversity. Aust Dent J 2014;59:13-22. [Crossref] [PubMed]
- Basu AK. DNA Damage, Mutagenesis and Cancer. Int J Mol Sci 2018;19: [Crossref] [PubMed]
- Avola R, Graziano Elenonora AC, Pannuzzo G, et al. Hydroxytyrosol from olive fruits prevents blue-light-induced damage in human keratinocytes and fibroblasts. J Cell Physiol 2019;234:9065-76. [Crossref] [PubMed]
- Casciaro F, Beretti F, Zavatti M, et al. Nuclear Nox4 interaction with prelamin A is associated with nuclear redox control of stem cell aging. Aging (Albany NY) 2018;10:2911-34. [Crossref] [PubMed]
- Billard JM. Changes in serine racemase-dependent modulation of NMDR receptor: Impact on physiological and pathological brain aging. Front Mol Biosci 2018;5:106. [Crossref] [PubMed]
- Dyall SC, Michael GJ, Whelpton R, et al. Dietary enrichment with omega-3 polyunsaturated fatty acids reverses age-related decreases in the GluR2 and NR2B glutamate receptor subunits in rat forebrain. Neurobiol Aging 2007;28:424-39. [Crossref] [PubMed]
- McGahon BM, Martin DS, Horrobin DF, et al. Age-related changes in synaptic function: analysis of the effect of dietary supplementation with omega-3 fatty acids. Neuroscience 1999;94:305-14. [Crossref] [PubMed]
- Morgan TJ, Scott PJ, Anstey CM. Rapid haemodilution accelerates hypertonicity resolution in diabetic ketoacidosis: data from 25 intensive care admissions. Crit Care Resusc 2019;21:274-83. [PubMed]
- Ding Y, Xin C, Zhang CW, et al. Natural Molecules From Chinese Herbs Protecting Against Parkinson's Disease via Anti-oxidative Stress. Front Aging Neurosci 2018;10:246. [Crossref] [PubMed]
- Görg B, Karababa A, Haussinger D. Hepatic Encephalopathy and Astrocyte Senescence. J Clin Exp Hepatol 2018;8:294-300. [Crossref] [PubMed]
- Schütte K, Schulz C, Malfertheiner P. Nutrition and Hepatocellular Cancer. Gastrointest Tumors 2016;2:188-94. [Crossref] [PubMed]
- Schütte K, Bornschein J, Malfertheiner P. Hepatocellular carcinoma--epidemiological trends and risk factors. Dig Dis 2009;27:80-92. [Crossref] [PubMed]
- Dyson J, Jaques B, Chattopadyhay D, et al. Hepatocellular cancer: the impact of obesity, type 2 diabetes and a multidisciplinary team. J Hepatol 2014;60:110-7. [Crossref] [PubMed]
- Bamia C, Lagiou P, Jenab M, et al. Coffee, tea and decaffeinated coffee in relation to hepatocellular carcinoma in a European population: multicentre, prospective cohort study. Int J Cancer 2015;136:1899-908. [Crossref] [PubMed]
- Setiawan VW, Wilkens LR, Lu SC, et al. Association of coffee intake with reduced incidence of liver cancer and death from chronic liver disease in the US multiethnic cohort. Gastroenterology 2015;148:118-25; quiz e15.
- Lai GY, Weinstein SJ, Albanes D, et al. The association of coffee intake with liver cancer incidence and chronic liver disease mortality in male smokers. Br J Cancer 2013;109:1344-51. [Crossref] [PubMed]
- Inoue M, Yoshimi I, Sobue TJPHC Study Group, et al. Influence of coffee drinking on subsequent risk of hepatocellular carcinoma: a prospective study in Japan. J Natl Cancer Inst 2005;97:293-300. [Crossref] [PubMed]
- Petrick JL, Freedman ND, Graubard BI, et al. Coffee Consumption and Risk of Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma by Sex: The Liver Cancer Pooling Project. Cancer Epidemiol Biomarkers Prev 2015;24:1398-406. [Crossref] [PubMed]
- Bravi F, Bosetti C, Tavani A, et al. Coffee reduces risk for hepatocellular carcinoma: an updated meta-analysis. Clin Gastroenterol Hepatol 2013;11:1413-1421.e1. [Crossref] [PubMed]
- Dinarello CA, Endres S. Role for interleukin-1 in the pathogenesis of hypersensitivity diseases. J Cell Biochem 1989;39:229-38. [Crossref] [PubMed]
- Lim K, Han C, Dai Y, et al. Omega-3 polyunsaturated fatty acids inhibit hepatocellular carcinoma cell growth through blocking beta-catenin and cyclooxygenase-2. Mol Cancer Ther 2009;8:3046-55. [Crossref] [PubMed]
- Khaksari M, Mazzoleni LR, Ruan C, et al. Determination of water-soluble and fat-soluble vitamins in tears and blood serum of infants and parents by liquid chromatography/mass spectrometry. Exp Eye Res 2017;155:54-63. [Crossref] [PubMed]
- Patel H, Chandra S, Alexander S, et al. Plant-based: An essential component of cardiovascular disease prevention and management. Curr Cardiol Rep 2017;19:104. [Crossref] [PubMed]
- Yang W, Diamond AM. Selenium-binding protein 1 as a tumor suppressor and a prognostic indicator of clinical outcome. Biomark Res 2013;1:15. [Crossref] [PubMed]
- Ansong E, Ying Q, Ekoue DN, et al. Evidence that selenium binding protein 1 is a tumor suppressor in prostate cancer. PLoS One 2015;10:e0127295. [Crossref] [PubMed]
- Jones P, Lucock M, Veysey M, et al. The Vitamin D−Folate Hypothesis as an Evolutionary Model for Skin Pigmentation: An Update and Integration of Current Ideas. Nutrients 2018;10: [Crossref] [PubMed]
- Lips P, van Schoor NM. The effect of vitamin D on bone and osteoporosis. Best Pract Res Clin Endocrinol Metab 2011;25:585-91. [Crossref] [PubMed]
- Nakashima A, Yokoyama K, Yokoo T, et al. Role of vitamin D in diabetes mellitus and chronic kidney disease. World J Diabetes 2016;7:89-100. [Crossref] [PubMed]
- Angellotti E, D'Alessio D, Dawson-Hughes B, et al. Vitamin D Supplementation in Patients With Type 2 Diabetes: The Vitamin D for Established Type 2 Diabetes (DDM2) Study. J Endocr Soc 2018;2:310-21. [Crossref] [PubMed]
- Sintzel MB, Rametta M, Reder AT. Vitamin D and Multiple Sclerosis: A Comprehensive Review. Neurol Ther 2018;7:59-85. [Crossref] [PubMed]
- Garinis GA, van der Horst GT, Vijg J, et al. DNA damage and ageing: new-age ideas for an age-old problem. Nat Cell Biol 2008;10:1241-7. [Crossref] [PubMed]
- Chen JH, Hales CN, Ozanne SE. DNA damage, cellular senescence and organismal ageing: causal or correlative? Nucleic Acids Res 2007;35:7417-28. [Crossref] [PubMed]
- Lobo V, Patil A, Phatak A, Chandra N. Free radicals, antioxidants and functional foods: Impact on human health. Pharmacogn Rev 2010;4:118-26. [Crossref] [PubMed]
- Phaniendra A, Jestadi DB, Periyasamy L. Free radicals: properties, sources, targets, and their implication in various diseases. Indian J Clin Biochem 2015;30:11-26. [Crossref] [PubMed]
- Calvo S, Jain M, Xie X, et al. Systematic identification of human mitochondrial disease genes through integrative genomics. Nat Genet 2006;38:576-82. [Crossref] [PubMed]
- Van Houten B, Hunter SE, Meyer JN. Mitochondrial DNA damage induced autophagy, cell death, and disease. Front Biosci (Landmark Ed) 2016;21:42-54. [Crossref] [PubMed]
- World Health Organization . Nutrition for health and development: a global agenda for combating malnutrition. World Health Organization 2000.
- World Health Organization . Diet, nutrition, and the prevention of chronic diseases: report of a joint WHO/FAO expert consultation. World Health Organization; 2003.
- de Onis M, Blössner M. The World Health Organization global database on child growth and malnutrition: methodology and applications. Int J Epidemiol 2003;32:518-26. [Crossref] [PubMed]
- Coppedè F, Migliore L. DNA damage and repair in Alzheimer's disease. Curr Alzheimer Res 2009;6:36-47. [Crossref] [PubMed]
- Fenech MF. Dietary reference values of individual micronutrients and nutriomes for genome damage prevention: current status and a road map to the future. Am J Clin Nutr 2010;91:1438S-54S. [Crossref] [PubMed]
- Fenech M. The Genome Health Clinic and Genome Health Nutrigenomics concepts: diagnosis and nutritional treatment of genome and epigenome damage on an individual basis. Mutagenesis 2005;20:255-69. [Crossref] [PubMed]
- Ames BN. DNA damage from micronutrient deficiencies is likely to be a major cause of cancer. Mutat Res 2001;475:7-20. [Crossref] [PubMed]
- Blount BC, Mack MM, Wehr CM, et al. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage: implications for cancer and neuronal damage. Proc Natl Acad Sci U S A 1997;94:3290-5. [Crossref] [PubMed]
- Wickramasinghe SN, Fida S. Bone marrow cells from vitamin B12-and folate-deficient patients misincorporate uracil into DNA. Blood 1994;83:1656-61. [Crossref] [PubMed]
- Rimm EB, Willett WC, Hu FB, et al. Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease among women. JAMA 1998;279:359-64. [Crossref] [PubMed]
- Rawling JM, Jackson TM, Driscoll ER, et al. Dietary niacin deficiency lowers tissue poly (ADP-ribose) and NAD+ concentrations in Fischer-344 rats. J Nutr 1994;124:1597-603. [Crossref] [PubMed]
- Henning SM, Swendseid ME, Coulson WF. Male rats fed methyl-and folate-deficient diets with or without niacin develop hepatic carcinomas associated with decreased tissue NAD concentrations and altered poly (ADP-ribose) polymerase activity. J Nutr 1997;127:30-6. [Crossref] [PubMed]
- Ziegler E, Filer L. Present knowledge in nutrition ILSI Press. Washington, DC 1996.
- Olin KL, Shigenaga MK, Ames BN, et al. Maternal dietary zinc influences DNA strand break and 8-hydroxy-2′-deoxyguanosine levels in infant rhesus monkey liver. Proc Soc Exp Biol Med 1993;203:461-6. [Crossref] [PubMed]
- Qian Y, Liu S, Lu F, et al. Genetic variant in fat mass and obesity-associated gene associated with type 2 diabetes risk in Han Chinese. BMC Genet 2013;14:86. [Crossref] [PubMed]
- Courties A, Gualillo O, Berenbaum F, et al. Metabolic stress-induced joint inflammation and osteoarthritis. Osteoarthritis Cartilage 2015;23:1955-65. [Crossref] [PubMed]
- Grundy SM. Inflammation, hypertension, and the metabolic syndrome. JAMA 2003;290:3000-2. [Crossref] [PubMed]
- Conde J, Scotece M, Gomez R, et al. Adipokines and osteoarthritis: novel molecules involved in the pathogenesis and progression of disease. Arthritis 2011;2011:203901. [Crossref] [PubMed]
- Popkin BM, Doak CM. The obesity epidemic is a worldwide phenomenon. Nutr Rev 1998;56:106-14. [Crossref] [PubMed]
- World Health Organization. Global strategy on diet, physical activity and health. World Health Organization 2004.
- Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell 2006;124:783-801. [Crossref] [PubMed]
- Murata C, Ramírez AB, Ramírez G, et al. Discriminant analysis to predict the clinical diagnosis of primary immunodeficiencies: a preliminary report. Revista Alergia México 2015;62:125-33. [PubMed]
- Vaillant AAJ, Qurie A. Immunodeficiency. StatPearls [Internet]. StatPearls Publishing; 2018.
- Routes J, Abinun M, Al-Herz W, et al. ICON: the early diagnosis of congenital immunodeficiencies. J Clin Immunol 2014;34:398-424. [PubMed]
- Stefanis L, Burke RE, Greene LA. Apoptosis in neurodegenerative disorders. Curr Opin Neurol 1997;10:299-305. [Crossref] [PubMed]
- McCord JM. The evolution of free radicals and oxidative stress Am J Med 2000;108:652-9. [Crossref] [PubMed]
- van Poppel G, Goldbohm RA. Epidemiologic evidence for beta-carotene and cancer prevention. Am J Clin Nutr 1995;62:1393S-402S. [Crossref] [PubMed]
- Glatthaar BE, Hornig DH, Moser U. The role of ascorbic acid in carcinogenesis. Essential Nutrients in Carcinogenesis. Springer; 1986. p. 357-77.
- Ulatowski L, Manor D. Vitamin E trafficking in neurologic health and disease. Annu Rev Nutr 2013;33:87-103. [Crossref] [PubMed]
- Bhattacharya PT, Misra SR, Hussain M. Nutritional Aspects of Essential Trace Elements in Oral Health and Disease: An Extensive Review. Scientifica (Cairo) 2016;2016:5464373. [Crossref] [PubMed]
- Chan S, Gerson B, Subramaniam S. The role of copper, molybdenum, selenium, and zinc in nutrition and health. Clin Lab Med 1998;18:673-85. [Crossref] [PubMed]
- Rai V, Abdo J, Agrawal S, et al. Vitamin D Receptor Polymorphism and Cancer: An Update. Anticancer Res 2017;37:3991-4003. [PubMed]
- Lu QJ, Bo YC, Zhao Y, et al. Glutathione S-transferase M1 polymorphism and esophageal cancer risk: An updated meta-analysis based on 37 studies. World J Gastroenterol 2016;22:1911-8. [Crossref] [PubMed]
- Bai YH, Lu H, Hong D, et al. Vitamin D receptor gene polymorphisms and colorectal cancer risk: a systematic meta-analysis. World J Gastroenterol 2012;18:1672-9. [Crossref] [PubMed]
- Yu Y, Lang Q, Chen Z, et al. The efficacy for unresectable hepatocellular carcinoma may be improved by transcatheter arterial chemoembolization in combination with a traditional Chinese herbal medicine formula: a retrospective study. Cancer 2009;115:5132-8. [Crossref] [PubMed]
- Saini SK, Rekers N, Hadrup SR. Novel tools to assist neoepitope targeting in personalized cancer immunotherapy. Ann Oncol 2017;28:xii3-xii10. [Crossref] [PubMed]
- Drisko JA, Chapman J, Hunter VJ. The use of antioxidants with first-line chemotherapy in two cases of ovarian cancer. J Am Coll Nutr 2003;22:118-23. [Crossref] [PubMed]
栾迪
中国科学院深圳先进技术研究院脑认知与脑疾病研究所。(更新时间:2021/7/25)

李超
教授。温州医科大学附属第二医院基础医学研究中心主任,休斯顿卫理公会医院博士后,申请主持国家及地方项目多项,发表SCI论文30余篇,H-index 24。申请获批中国发明专利5项,专利转化并医疗器械注册证2项(III类)。(更新时间:2021/7/25)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Qazi AM, Tabassum R, Arshad F, Shaukat A, Qazi W, Javaid MT, Manan A. Nutrition, disease and underlying molecular mechanisms. Precis Cancer Med 2020;3:15.

