精准医学:BRAF突变甲状腺癌
引言
甲状腺癌是高流行、死亡率低的恶性肿瘤。基于SEER数据库可知,在美国,2019年预计有52 070例新发甲状腺癌病例((14260例男性和37810例女性)且2170例死亡[1]。标准治疗的总体治愈率高,包括手术和放射性碘治疗,但仍有患者因标准治疗失败或无其他选择而死于该病。为这类患者甄别治疗方法是关键。
甲状腺癌的不同组织学亚型包括乳头状、滤泡状、髓质和间变性肿瘤,具有各自相应的病理学和临床特征,疾病相关的死亡率也有所差异。亚组间的基因变化各异,其临床意义也不同。常见的改变包括RET/PTC重排、BRAF点突变、RAS突变和TP53突变[2]。在甲状腺乳头癌(PTC)中,BRAF突变和特定BRAF V600E突变为最常见的改变。BRAF V600E突变与侵袭性临床病理特征相关且可增加疾病相关的死亡率。非V600 BRAF突变也可发生,但相关有用的临床数据更少。BRAF突变可为侵袭性甲状腺癌患者提供治疗靶向。了解这些突变的机制和针对肿瘤细胞增殖的信号通路异常的靶向药物的作用,对于进一步降低甲状腺癌相关的死亡率至关重要。
病例介绍
该患者系男性,77岁,行腰椎磁共振示L4处5 cm膨胀性肿块,于2013年11月初次诊断为甲状腺癌。分期的胸腹盆CT示右侧甲状腺肿大。骨扫描示双侧胸腔和左侧胸锁关节活性灶。患者于2014年1月接受L3-L5椎体放疗。手术病理示3.6 cm低分化甲状腺癌伴滤泡样和乳头样特征,局部区域高分化和淋巴结转移。2014年3月,患者复查MRI检查示持续性L4膨胀性肿块,后接受了200 mci放射性碘治疗和甲状腺抑制疗法。2014年8月,复查PET扫描示患者胸骨和L4病灶的轻度溶骨性FDG增高,其后予地舒单抗治疗。多次影像学符合肺多发转移和多发骨病灶进展表现。患者口服仑伐替尼,24 mg/日,始于2017年6月,伴随多种毒性反应包括疲劳、体重下降和腹泻,故于2018年3月减量至14 mg/日。
2018年9月,PET-CT提示肺和骨病灶进展,且甲状腺球蛋白在2个月间从195上升至434,提示仑伐替尼耐药。鉴于多线治疗后的疾病进展,通过Foundation One的ctDNA检测进行可操作的突变评估。ctDNA检测示BRAF K601E突变和CHEK2位点e 592+1G>A及TP53 Q136H突变。
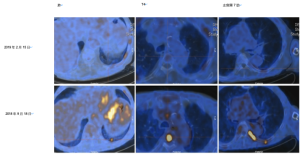
鉴于上述检测发现和文献回顾,予以患者BRAF抑制剂(达拉非尼)联合丝裂原胞外激酶(MEK)抑制剂(曲美替尼)治疗。复查影像学示治疗明显缓解(图1),但考虑到不良反应,包括严重下肢水肿,近6周(后3周治疗仅使用单药曲美替尼)后治疗暂停。尽管影像学结果提示治疗疗效显著,但由于毒性和随后的机体快速衰退,后者与甲状腺球蛋白上升及明确的影像学疾病进展(脊柱MRI示新发巨大的腰骶部病变),患者仍进入临终关怀治疗。
分子肿瘤版
甲状腺癌的分子改变
甲状腺的形式多样,各自具备不同的病理、分子和临床特征,主要亚型包括乳头状(最常见,占病例的80%)、滤泡状(包括Hurthle细胞)、髓样癌和间变癌。一些普遍存在的基因改变在不同的亚组中少见(表1),包括RET/PTC重排、BRAF点突变、RAS突变和PAX8-过氧化物酶体增殖物激活受体γ(PPARγ)融合癌基因[3,4]。上述突变常不共存于其他主要的驱动基因突变[5]。因此,BRAF突变更常见于成年人,并且作为主要的体细胞基因改变促进PTC形成[5]。此外,RET/PTC重排倾向于发生在儿童中,并在相应的人群中作为主要的体细胞基因改变促进PTC形成。理解不同的分子学改变尤其重要,因为其具有治疗作用。
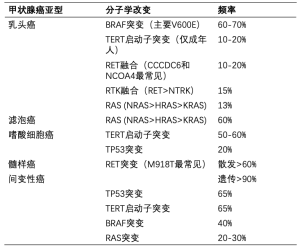
Full table
RET突变
RET作为原癌基因编码受体酪氨酸激酶家族的跨膜蛋白,主要表达于神经外胚层来源的组织。当发生突变时,它可驱动不同恶性肿瘤的发展,包括甲状腺乳头状癌(RET融合)和甲状腺髓样癌(RET突变)。大多数甲状腺髓样癌是偶发的,但近25%者为遗传病并可继发于MEN2A、MEN2B或其他非MEN的家族性疾病。RET改变者的经典治疗为多酪氨酸抑制剂药物,包括卡博替尼和凡德他尼;然而,该类药物因靶向选择性低而表现出强毒性。LOXO-292是强效并具备高选择性的RET抑制剂(不依赖融合和突变);在既往治疗后进展的晚期RET融合阳性甲状腺癌中,其被誉为突破性方案设计,且无其他替代选择。该方案基于LIBRETTO-001临床试验结果,后者为晚期RET融合阳性的实体瘤和甲状腺髓样癌的1/2期临床研究,初步结果公布于2018年的美国甲状腺协会[6]。该研究入组29例RET突变甲状腺髓样癌患者和9例RET融合阳性甲状腺癌患者。患者进行强化治疗,总体缓解率在RET突变的甲状腺髓样癌中为56%(95%CI;35%~75%),在RET融合阳性的甲状腺癌中为78%(95%CI;40%~97%)。在ARROW研究中,BLU-667,另一种RET选择性抑制剂,证明了具有RET基因改变的甲状腺癌的临床活性。该临床研究入组了60例RET突变甲状腺髓样癌和5例RET融合阳性PTC患者,总体缓解率为47%(95%CI:33%~62%)且缓解的发生与MKI耐药或RET基因型无关[7]。
BRAF突变
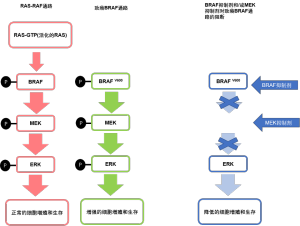
甲状腺癌的BRAF突变大多发生于PTC和PTC衍生的间变性甲状腺癌(ATC)。其可分为经典V600E突变、其他RAF非-V600E突变、RAF融合和RAF缺失。BRAF突变可以引起BRAF蛋白的超级活化,导致MAP激酶通路活性增高并继发肿瘤形成。MEK蛋白位于MAP激酶通路的下游,亦由这些突变引发超活化[8](图2)。
BRAF突变中,BRAF V600E突变是最为常见的,且比例超过90%[9,10]。BRAF V600E位点突变,在外显子15的1 799位通过腺嘌呤替换胸腺嘧啶,导致谷氨酰胺替换残基600的缬氨酸。在高分化的甲状腺癌中,其作为早期并常见的驱动基因突变,和后续的晚发突变促进ATC的进展性去分化。
非V600E突变(如本病例)可以升高或降低野生型BRAF的激酶活性。肿瘤形成可通过V600E突变相似的激酶活性失调,或通过提高伴侣原聚体CRAF的二聚化/反式活化,最终导致超活化。上述突变可以造成BRAF基本活化,逃避ERK介导的反馈。
BRAF抑制剂的作用早期已经在V600E突变患者中研究,大部分文献来源于恶性黑色素瘤。第一代BRAF抑制剂包括维罗非尼和达拉非尼。上述药物仅阻断突变BRAF单体(非二聚体),且与发生耐药的风险提高相关,亦有促癌的不良反应,其中包括皮肤癌。皮肤毒性归因于表皮细胞的RAS突变和旁路抑制BRAF,反常激活MAP激酶通路。二代BRAF抑制剂,包括索拉非尼和LYS3009120(pan-RAF抑制剂)抑制活性BRAF(二聚体)形式,并减少Ras突变细胞的反式通路激活。MEK抑制剂,包括曲美替尼和司美替尼,与BRAF抑制剂的单药治疗相比,可阻断MAP激酶信号通路中的MEK激酶活性,能降低反式ERK活化相关不良反应风险。
BRAF抑制剂单药治疗,或联合MEK抑制剂治疗的数据最初基于V600突变的研究。BRAF V600E或V600K突变的恶性黑色素瘤患者在联合治疗后对比达拉非尼单药治疗,在缓解率和缓解时间上有获益[11]。近期的V600E或V600K突变的晚期恶性黑色素瘤研究回顾5年的一线达拉非尼和曲美替尼的联合治疗,提示近1/3患者长期获益[12]。Ⅱ期临床试验中,维罗非尼用于BRAF V600E阳性的转移性或不可切除的放射性碘治疗后复发的甲状腺乳头状癌,在未接受靶向VEGFR的多激酶抑制剂人群有38.5%部分缓解[13],尽管3级和4级不良事件发生率高。最近,一项II期的开放标签临床试验观察了BRAF V600E突变的间变性甲状腺癌中达拉非尼和曲美替尼的联合治疗有效性和安全性[14]。16名患者入组研究且总体缓解率为69%(95%CI:41%~89%)。1例患者达到完全缓解,10例患者达到部分缓解,7例患者在分析时仍持续缓解。因此FDA批准达拉非尼联合曲美替尼用于BRAF V600E突变的间变型甲状腺癌。
BRAF K601E
虽然BRAF V600E是最广为公认的BRAF改变,但BRAF K601E突变也在患者中得到关注。这是BRAF基因组密码子K601特定突变,将BRAF601位点的赖氨酸替代为谷氨酸,并导致持续升高的激酶活性。突变在激酶域的活化片断并与V600相邻。此突变发生于5%的恶性黑色素瘤患者中,并且是常见BRAF突变中位居第三[15,16]。
临床前期研究提示K601E突变诱发的下游信号通路可由曲美替尼阻断。在恶性黑色素瘤的研究中,维罗非尼治疗所有BRAF突变表达细胞,可导致磷酸化MEK和ERK蛋白水平的下降,然而MEK抑制剂治疗可造成磷酸化ERK信号的急剧减低,提示两种药物的疗效[15]。在曲美替尼治疗晚期BRAF突变的皮下恶性黑色素瘤的Ⅱ期研究中,一例BRAF K601E突变患者部分缓解[17]。在个案报道中,一例BRAF K601E突变的恶性黑色素瘤患者经曲美替尼单药治疗后完全缓解超过36个月[18]。基于该病例和BRAF抑制剂/MEK抑制剂在BRAF V600突变ATC的联合治疗数据,我们的分子肿瘤组达到联合治疗的共识。
总结
该病例强调分子靶点的检测在标准治疗后进展的甲状腺癌治疗中的重要性。目前,BRAF和MEK抑制剂在甲状腺癌治疗中的获批主要限于ATC。在复发的已知BRAF突变的甲状腺癌中,达拉非尼联合或不联合曲美替尼治疗的研究仍在进行(NCT01723202)。此外,MATCH筛选研究(NCT02465060)对BRAF V600突变者进行达拉非尼和曲美替尼联合治疗评估,其中BRAF非V600突变者予以单药曲美替尼的臂组已完成,同时观察单药MEK抑制剂,ulixertinib治疗BRAF非V600E/K突变或BRAF融合组仍在进行。这些研究结果和其他会有助于阐明上述药物治疗在BRAF突变甲状腺乳头状癌和其他BRAF驱动的恶性肿瘤中的作用。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Precision Cancer Medicine for the series “Precision Oncology Tumor Board”. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/pcm.2019.09.04). The Series “Precision Oncology Tumor Board” was commissioned by the editorial office without any funding or sponsorship. BH serves the unpaid Guest Editor of the series and as an unpaid editorial board member of Precision Cancer Medicine from Apr 2019 to Mar 2021. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- SEER Cancer Stat Facts: Thyroid Cancer. [database on the Internet]. April 2019. Available online: https://seer.cancer.gov/statfacts/html/thyro.html
- Xing M. BRAF Mutation in Papillary Thyroid Cancer: Pathogenic Role, Molecular Bases, and Clinical Implications. Endocr Rev 2007;28:742-62. [Crossref] [PubMed]
- Leonardi GC, Candido S, Carbone M, et al. BRAF mutations in papillary thyroid carcinoma and emerging targeted therapies. Mol Med Rep 2012;6:687-94. [Crossref] [PubMed]
- Pozdeyev N, Gay LM, Sokol ES, et al. Genetic Analysis of 779 Advanced Differentiated and Anaplastic Thyroid Cancers. Clin Cancer Res 2018;24:3059-68. [Crossref] [PubMed]
- Kimura ET, Nikiforova MN, Zhu Z, et al. High Prevalence of BRAF Mutations in Thyroid Cancer. Cancer Res 2003;63:1454-7. [PubMed]
- Wirth LJ, Cabanillas ME, Sherman E, et al. Clinical activity of LOXO-292, a highly selective RET inhibitor, in patients with RET-altered thyroid 88th Annual Meeting of the American Thyroid Association; October 3-7 2018; Washington, D.C.
- Taylor MH, Gainor JF, Hu MIN, et al. Activity and tolerability of BLU-667, a highly potent and selective RET inhibitor, in patients with advanced RET-altered thyroid cancers. J Clin Oncol 2019;37:6018. [Crossref]
- Ballif BA, Blenis J. Molecular Mechanisms Mediating Mammalian Mitogen-activated Protein Kinase (MAPK) Kinase (MEK)-MAPK Cell Survival Signals. Cell Growth Differ 2001;12:397-408. [PubMed]
- Giordano TJ, Kuick R, Thomas DG, et al. Molecular classification of papillary thyroid carcinoma: distinct BRAF, RAS, and RET/PTC mutation-specific gene expression profiles discovered by DNA microarray analysis. Oncogene 2005;24:6646-56. [Crossref] [PubMed]
- Garnett MJ, Marais R. Guilty as charged: B-RAF is a human oncogene. Cancer Cell 2004;6:313-9. [Crossref] [PubMed]
- Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK Inhibition versus BRAF Inhibition Alone in Melanoma. N Engl J Med 2014;371:1877-88. [Crossref] [PubMed]
- Robert C, Grob JJ, Stroyakovskiy D, et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 2019;381:626-36. [Crossref] [PubMed]
- Brose MS, Cabanillas ME, Cohen EEW, et al. Vemurafenib in patients with BRAF(V600E)-positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine: a non-randomised, multicentre, open-label, phase 2 trial. Lancet Oncol 2016;17:1272-82. [Crossref] [PubMed]
- Subbiah V, Kreitman RJ, Wainberg ZA, et al. Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol 2018;36:7-13. [Crossref] [PubMed]
- Dahlman KB, Xia J, Hutchinson K, et al. BRAF Mutations in Melanoma Are Associated with Sensitivity to MEK Inhibitors. Cancer Discov 2012;2:791-7. [Crossref] [PubMed]
- Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature 2002;417:949-54. [Crossref] [PubMed]
- Kim KB, Kefford R, Pavlick AC, et al. Phase II study of the MEK1/MEK2 inhibitor Trametinib in patients with metastatic BRAF-mutant cutaneous melanoma previously treated with or without a BRAF inhibitor. J Clin Oncol 2013;31:482-9. [Crossref] [PubMed]
- Marconcini R, Galli L, Antonuzzo A, et al. Metastatic BRAF K601E-mutated melanoma reaches complete response to MEK inhibitor trametinib administered for over 36 months. Exp Hematol Oncol 2017;6:6. [Crossref] [PubMed]

戴映
安徽医科大学第一附属医院 肿瘤内科
主治医师,肿瘤学博士
主攻胸部肿瘤内科治疗
2014年毕业于海德堡大学医学院
2017年德国汉堡大学UKE医院肿瘤中心访问学者
2017年入选全球卫生后备人才库
主持课题3项,参与省级课题多项,德国科学研究基金及德国癌症援助基金各1项
2013年度美国波士顿ASTRO会议及德国DEGRO会议壁报汇报
2020年新加坡世界肺癌大会壁报汇报
以第一作者发表SCI论文2篇,通讯作者发表SCI论文1篇
「学术任职」
安徽省全科医学会肿瘤内科分会青年委员
中国抗癌协会肿瘤营养专业委员会老年肿瘤营养学组委员
(更新时间:2021/9/5)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Podolski A, Castellucci E, Halmos B. Precision medicine: BRAF mutations in thyroid cancer. Precis Cancer Med 2019;2:29.