靶向非小细胞肺癌中的ErbB2突变
人表皮生长因子2(HER2或ErbB2)是受体酪氨酸激酶ERBB家族成员,该家族还包括EGFR、HER3和HER4。这些激酶受体都包含一个胞外配体结合区、一个疏水跨膜结构域以及一个具有酪氨酸激酶催化活性的胞内结构域。当配体与EGFR、HER3及HER4等受体的胞外结构域结合时,这些受体形成异二聚体,进而激活各种信号级联反应,包括raf/丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇-4,5-二磷酸3-激酶(PI3K)和蛋白激酶C(PKC)通路。上述信号途径在细胞增殖、分化、血管生成和抗细胞凋亡中发挥重要作用。有趣的是,虽然它在结构上与其家族其他成员非常相似,但是目前未发现ErbB2特异性配体。相反,ErbB2作为其他受体激酶的首选二聚化成分形成复合物并产生激活效应。与此同时,包含ErbB2的异二聚体化学性质相当稳定,其生化效应更高[1]。因此,ErbB2的失调和过度表达导致前述异源二聚体增加,进而激活信号级联反应以增强细胞增殖能力,最终成为促进肿瘤发生的驱动因素。因此,针对ErbB2的扩增和突变现主要有两种治疗策略:其一,针对细胞外结构域的抗体(及抗体-药物偶联物);其二,针对细胞内激酶结构域的酪氨酸激酶抑制剂(TKI)。其中最有希望的药物是波奇替尼,它是一种新型的、基于喹唑啉的不可逆性结合的酪氨酸激酶抑制剂,其已在外显子20突变患者中显示出疗效。
病例详情
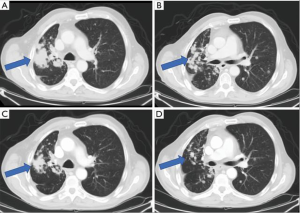
本病例是一位68岁的男性患者,有长期吸烟史,既往无明确慢性疾病等病史,其首发症状表现为持续性咳嗽,并在数月内加重。胸部CT提示右上叶肿块伴相关引流区淋巴结肿大,全身PET-CT提示在其肝脏、肾上腺和骨中PET代谢性浓聚,考虑转移性病变。随后我们对患者进行CT定位引导右侧髂骨穿刺活检,病理结果显示穿刺组织TTF1表达阳性,考虑腺癌来源于肺。遗憾的是,上述穿刺活检组织的组织量较少,无法满足后续进行肺癌相关分子检测所需。后患者进一步行脑部磁共振,提示颅内多发小病灶(最大直径小于4 mm),考虑脑多发转移瘤。经沟通后再次行骨病灶穿刺活检,组织分子检测结果显示EGFR/ALK突变皆为阴性,同时确诊为肺腺癌晚期伴ErbB2 YVMA突变阳性。后续对该患者进行脑转移瘤的立体定向放射治疗(Stereotactic Radiosurgery,SRS),治疗结束后复查脑部磁共振提示,除一个病灶残留外,其余颅内多发病灶均已消退,呈放射治疗相关的颅内信号改变。后患者继续行双药化疗联合免疫治疗(卡铂/培美曲塞/派姆单抗),最初肿瘤缓解明显,疗效显著。然而,经过8至9个月的治疗后,复查提示左半骨盆骨转移进展。再次进行分子检测证实仍存在上述ErbB2突变。随后患者继续行二线治疗——单药化疗联合抗血管生成治疗(多西他赛/雷莫芦单抗)。此患者在使用上述方案2至3个周期后出现治疗相关的严重不良反应,随后在外院开始使用抗ErbB的靶向-化疗偶联药物恩美曲妥珠单抗(ado-trastuzumab emtansine,T-DM1)。但是,几个月后复查发现中枢神经系统(CNS)转移灶较前进展,随即接受了全脑放射治疗。随后他再次来我院就诊,并根据临床研究方案开始口服波奇替尼16 mg/日。仅经过一个周期的治疗,影像学检查提示转移灶较前缓解,肿瘤负荷显著减少(图1)。不幸的是,患者后续出现严重的药物相关毒性,无法继续服用研究药物,最终体力状况等评分下降。
肿瘤分子机制探讨
ErbB2激活导致癌症主要通过如下三种机制:扩增与过表达、受体的体细胞突变和抑制磷酸酶活性[2]。ErbB2扩增首先在乳腺癌中被发现,15%~30%的浸润性乳腺癌中可检测到此突变。因为它与较短的无进展生存期和总生存期相关,所以可以用来预测病情及判断预后[3]。现已在各种其他恶性肿瘤中发现ErbB2扩增,包括卵巢癌、子宫癌、胃癌、结肠癌、膀胱癌、肺癌,并且在胃腺癌中已证实其为有效治疗靶点。最新研究表明,各种体细胞突变也可能导致ErbB2基因的失调。上述现象首先在肺腺癌中发现,也已在各种其他恶性肿瘤中发现。ErbB2突变与EGFR突变互斥表达,前者更常见于非吸烟患者、女性、亚裔癌患者[4]。ErbB2的活化可由激酶域中的错义突变或插入引起,也可由错义突变(如S310单点替换突变)或胞外域的缺失引起。ErbB2最常见的突变涉及外显子20的框内插入,例如密码子776处的YVMA插入。这些突变导致自身抑制性αC-β4环的构象改变,从而缩小ATP结合位点,进而促进复合激酶活性[5]。而不常见的突变形式是胞外区的错义突变。通过诱导二硫键形成(例如S335C、G309E)或通过增加C末端尾部磷酸化(例如S3105和S310Y)来增强复合激酶活性[6]。最后,ErbB2可通过抑制磷酸酶活性而被激活。体外研究表明,PTPN12磷酸酶的失活促进了ErbB2的激活[7]。
目前可以使用各种方法检测ErbB2突变,包括酶联免疫吸附分析(ELISA)、免疫组织化学(IHC)、荧光原位杂交(FISH)以及二代测序(NGS)[4,8,9]。然而,这些检测方法都不是金标准。传统检测方面,检测ErbB2扩增最常用的方法是免疫组织化学(IHC)以量化ErbB2蛋白表达水平,或荧光原位杂交(FISH)以确定ErbB2基因拷贝数。虽然前者广泛应用且操作简便,但结果不稳定,并取决于多种因素,如包括使用的抗体以及阳性临界值的设定。另外,FISH检测并不普及,但特异性更高。因此,在乳腺癌中,IHC通常用作筛查试验,如果结果不明确,则进行FISH确证。然而,在非小细胞肺癌(NSCLC)中,这种检测方法应用有限,因为IHC检测和FISH检测结果之间通常存在显著差异[10]。最近,双原位杂交(DISH)与FISH相比被证明在检测ErbB2扩增方面更好[11]。此外,可以使用Sanger测序、NGS以及质谱基因分型检测ErbB2突变。其中,NGS高度敏感,可以检测各种突变、重排和扩增,是肺癌分子检测的首选方法,因为它可以检测所有潜在的可用突变。
具有ErbB2突变的患者比其他驱动因素致癌患者的总生存期更短[12],为此突变类型患者开发最佳靶向治疗的需求仍很迫切。目前,主要采取两种策略以靶向ErbB2的扩增及突变,即针对细胞外结构域的抗体(和抗体-药物偶联物)和针对细胞内激酶结构域的TKI[2]。
曲妥珠单抗是一种靶向ErbB2受体胞外结构域的人源化单克隆抗体,是ErbB2扩增型乳腺癌的标准治疗方案。遗憾的是,在非小细胞肺癌的早期临床研究中曲妥珠单抗联合单药化疗[13]或与吉西他滨-顺铂[14]或多西他赛[15]联合使用时,未观察到类似乳腺癌中的良好疗效或生存获益。但是需要注意的是,上述早期临床试验是通过免疫组化来选择ErbB2阳性表达患者,而我们现在知道ErbB2突变并不总是导致ErbB2过表达,ErbB2突变本身可能在非小细胞肺癌发生中发挥更重要的作用。最近的回顾性分析提出了更有治疗前景的结果。2013年的一项研究入组了65位ErbB2突变阳性的患者,其中16位患者在常规化疗后接受了曲妥珠单抗的维持治疗,最终上述患者疾病控制率为96%[16]。另外,对101例ErbB2外显子20突变的患者进行类似的回顾性分析,确定有65例在常规化疗后接受靶向ErbB2的治疗。其中,57例曾接受曲妥珠单抗联合化疗,统计显示疾病控制率为50%,依此推荐使用上述联合方案[17]。T-DM1是一种靶向ErbB2的抗体-药物偶联物,也在临床应用中显示出一定的效果。Li等人2018年的一项临床研究显示,18例晚期ErbB2突变阳性肺腺癌患者接受T-DM1治疗的部分缓解率为44%,中位无进展生存期(PFS)为5个月[18]。这些患者具有不同类型的ErbB2突变,包括外显子20插入和跨膜段及胞外段中的点突变。
目前,研究证实针对ErbB2的酪氨酸激酶抑制剂也具有一定的疗效。阿法替尼是一种靶向EGFR、ErbB2和HER4的非可逆性结合TKI,相关临床病例报告及回顾性研究提示其具有一定疗效。有报道显示3例具有不同类型ErbB2外显子20突变的患者在使用TKI后肿瘤得到部分缓解,并且缓解时间持续长达4个月[19]。另有案例报告显示,一例具有常见的外显子20 YVMA插入突变的患者获得了更久的持续缓解时间,时间长达10个月[20]。此外,一项国际回顾性研究显示27例ErbB2突变阳性转移癌患者用药后有15%的患者获得肿瘤部分缓解[21]。现有研究亦证实,靶向EGFR、ErbB2及HER4的第二代不可逆结合抑制剂-达可替尼(Dacomitinib)也具有一定的临床疗效。一项Ⅱ期临床试验共入组30例ErbB2突变或扩增的患者,发现ErbB2突变阳性的病例有12%的患者获得部分缓解,且缓解时间最长持续了14个月。而在具有ErbB2扩增或常见的外显子20插入突变(A775_G776insYVMA)的患者中则没有病例获得部分缓解[22]。在一项入组了43例ErbB2突变患者的临床队列研究中,二代酪氨酸激酶抑制剂来那替尼(Neratinib)与靶向哺乳动物雷帕霉素(mTOR)信号途径的抑制剂替西罗莫司(Temsirolimus)联合使用时[23],治疗有效反应率达到19%,同时取得了长达18个月的无疾病进展生存时间。拉帕替尼是一种抑制ErbB1和ErbB2的双重TKI,现已证明对HER2阳性乳腺癌有效,但在非小细胞肺癌中则无效。最近有临床前研究提示,奥希替尼也可能有效靶向ErbB2突变,尤其是扩增型突变[24]。Tarloxotinib是一种在乏氧微环境下释放不可逆性EGFR/ErbB2酪氨酸激酶抑制剂的前药,最近在体内研究中发现其对外显子20突变的两种腺癌细胞系的鼠异种肿瘤移植模型也显示出抑瘤效果[25, 26]。模型小鼠在给予Tarloxotinib治疗4周后,肿瘤负荷显著降低,而作为对照组的阿法替尼则未能控制肿瘤生长。
尽管ErbB2酪氨酸酶抑制剂确实显示出一些疗效,但总体有效反应率过低,因此目前没有获批用于治疗ErbB2突变阳性肺癌。但是,最近更新的研究结果令人鼓舞。TAK-788(AP32788)是一种在研的靶向EGFR和ErbB2突变的TKI,正用于一项多中心的、开放标签的Ⅰ/Ⅱ期临床试验。该研究基于肿瘤基因型结果调整递增给药剂量和扩展分组队列。试验初期数据显示EGFR外显子20插入突变患者[27]的肿瘤部分缓解率为21%(n=14),而且最近公布的数据显示可评估的26位患者的肿瘤客观缓解率位54%,疾病控制率为89%[28]。其他正在进行的临床试验将有助于评估靶向ErbB2突变患者的疗效[29]。波奇替尼的试验结果同样令人振奋,它是一种新型的、基于喹唑啉的不可逆结合EGFR、ErB2和HER4的抑制剂。这种强效、分子量较小且构象灵活的抑制剂对外显子20突变的患者更为有效,因为其改变并减小了药物结合域的大小。两相比较,大多数分子量较大的TKI较其显得疗效欠佳[30]。一项入组50例EGFR突变或ErbB2外显子20突变的转移性肺腺癌患者的Ⅰ/Ⅱ期临床试验显示,ErbB2组的客观缓解率为50%,疾病控制率为83%[31]。同时,该组别患者的平均PFS为5.1个月(表1)。后续需要进一步的临床研究来确定前述不同药物的功效。
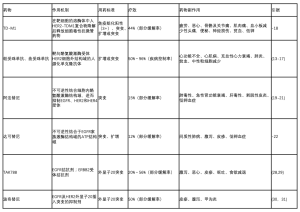
Full table
结论
我们的患者对波奇替尼表现出初步反应性,这提示在非小细胞肺癌中针对ErbB2突变治疗的潜在可行性,但是需要更多数据以进一步评估其在外显子20的YVMA插入突变中的有效性。我们的研究进一步提示了开发精准靶向各种ErbB2突变药物的重要性,特别是常见的外显子20 YVMA突变,因为上述这些分子改变导致各种靶向ErbB2的药物具有不同反应性及疗效。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Precision Cancer Medicine for the series “Precision Oncology Tumor Board”. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/pcm.2019.09.05). The Series “Precision Oncology Tumor Board” was commissioned by the editorial office without any funding or sponsorship. BH serves as the unpaid Guest Editor of the series and an unpaid editorial board member of Precision Cancer Medicine from Apr 2019 to Mar 2021. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Yarden Y. Biology of HER2 and its importance in breast cancer. Oncology 2001;61:1-13. [Crossref] [PubMed]
- Herter-Sprie GS, Greulich H, Wong KK. Activating Mutations in ERBB2 and Their Impact on Diagnostics and Treatment. Front Oncol 2013;3:86. [Crossref] [PubMed]
- Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987;235:177-82. [Crossref] [PubMed]
- Arcila ME, Chaft JE, Nafa K, et al. Prevalence, clinicopathologic associations, and molecular spectrum of ERBB2 (HER2) tyrosine kinase mutations in lung adenocarcinomas. Clin Cancer Res 2012;18:4910-8. [Crossref] [PubMed]
- Gazdar AF, Shigematsu H, Herz J, et al. Mutations and addiction to EGFR: the Achilles 'heal' of lung cancers? Trends Mol Med 2004;10:481-6. [Crossref] [PubMed]
- Greulich H, Kaplan B, Mertins P, et al. Functional analysis of receptor tyrosine kinase mutations in lung cancer identifies oncogenic extracellular domain mutations of ERBB2. Proc Natl Acad Sci U S A 2012;109:14476-81. [Crossref] [PubMed]
- Sun T, Aceto N, Meerbrey KL, et al. Activation of multiple proto-oncogenic tyrosine kinases in breast cancer via loss of the PTPN12 phosphatase. Cell 2011;144:703-18. [Crossref] [PubMed]
- Krishnamurti U, Silverman JF. HER2 in breast cancer: a review and update. Adv Anat Pathol 2014;21:100-7. [Crossref] [PubMed]
- Stephens P, Hunter C, Bignell G, et al. Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature 2004;431:525-6. [Crossref] [PubMed]
- Mar N, Vredenburgh JJ, Wasser JS. Targeting HER2 in the treatment of non-small cell lung cancer. Lung Cancer 2015;87:220-5. [Crossref] [PubMed]
- Yoshizawa A, Sumiyoshi S, Sonobe M, et al. HER2 status in lung adenocarcinoma: a comparison of immunohistochemistry, fluorescence in situ hybridization (FISH), dual-ISH, and gene mutations. Lung Cancer 2014;85:373-8. [Crossref] [PubMed]
- Pillai RN, Behera M, Berry LD, et al. HER2 mutations in lung adenocarcinomas: A report from the Lung Cancer Mutation Consortium. Cancer 2017;123:4099-105. [Crossref] [PubMed]
- Clamon G, Herndon J, Kern J, et al. Lack of trastuzumab activity in nonsmall cell lung carcinoma with overexpression of erb-B2: 39810: a phase II trial of Cancer and Leukemia Group B. Cancer 2005;103:1670-5. [Crossref] [PubMed]
- Gatzemeier U. Pemetrexed in malignant pleural mesothelioma. Oncology (Williston Park) 2004;18:26-31. [PubMed]
- Lara PN Jr, Chee KG, Longmate J, et al. Trastuzumab plus docetaxel in HER-2/neu-positive prostate carcinoma: final results from the California Cancer Consortium Screening and Phase II Trial. Cancer 2004;100:2125-31. [Crossref] [PubMed]
- Mazieres J, Peters S, Lepage B, et al. Lung cancer that harbors an HER2 mutation: epidemiologic characteristics and therapeutic perspectives. J Clin Oncol 2013;31:1997-2003. [Crossref] [PubMed]
- Mazieres J, Barlesi F, Filleron T, et al. Lung cancer patients with HER2 mutations treated with chemotherapy and HER2-targeted drugs: results from the European EUHER2 cohort. Ann Oncol 2016;27:281-6. [Crossref] [PubMed]
- Li BT, Shen R, Buonocore D, et al. Ado-Trastuzumab Emtansine for Patients With HER2-Mutant Lung Cancers: Results From a Phase II Basket Trial. J Clin Oncol 2018;36:2532-7. [Crossref] [PubMed]
- De Greve J, Teugels E, Geers C, et al. Clinical activity of afatinib (BIBW 2992) in patients with lung adenocarcinoma with mutations in the kinase domain of HER2/neu. Lung Cancer 2012;76:123-7. [Crossref] [PubMed]
- Li BT, Lee A, O'Toole S, et al. HER2 insertion YVMA mutant lung cancer: Long natural history and response to afatinib. Lung Cancer 2015;90:617-9. [Crossref] [PubMed]
- Lai WV, Lebas L, Barnes TA, et al. Afatinib in patients with metastatic or recurrent HER2-mutant lung cancers: a retrospective international multicentre study. Eur J Cancer 2019;109:28-35. [Crossref] [PubMed]
- Kris MG, Camidge DR, Giaccone G, et al. Targeting HER2 aberrations as actionable drivers in lung cancers: phase II trial of the pan-HER tyrosine kinase inhibitor dacomitinib in patients with HER2-mutant or amplified tumors. Ann Oncol 2015;26:1421-7. [Crossref] [PubMed]
- Gandhi L, Bahleda R, Tolaney SM, et al. Phase I study of neratinib in combination with temsirolimus in patients with human epidermal growth factor receptor 2-dependent and other solid tumors. J Clin Oncol 2014;32:68-75. [Crossref] [PubMed]
- Liu S, Li S, Hai J, et al. Targeting HER2 Aberrations in Non-Small Cell Lung Cancer with Osimertinib. Clin Cancer Res 2018;24:2594-604. [Crossref] [PubMed]
- Salem A, Asselin MC, Reymen B, et al. Targeting Hypoxia to Improve Non-Small Cell Lung Cancer Outcome. J Natl Cancer Inst 2018; [Crossref] [PubMed]
- Estrada-Bernal A, Doak AE, Le AT, et al. Abstract A157: Antitumor activity of tarloxotinib, a hypoxia-activated EGFR TKI, in patient-derived lung cancer cell lines harboring EGFR exon 20 insertions. In: Proceedings of the AACR-NCI-EORTC International Conference: Molecular Targets and Cancer Therapeutics, 2017.
- Doebele RC, Riely GJ, Spira AI, et al. First report of safety, PK, and preliminary antitumor activity of the oral EGFR/HER2 exon 20 inhibitor TAK-788 (AP32788) in non–small cell lung cancer (NSCLC). J Clin Oncol 2018;36:abstr 9015.
- Janne PA, Neal JW, Camidge DR, et al. Antitumor activity of TAK-788 in NSCLC with EGFR exon 20 insertions. J Clin Oncol 2019;37:abstr 9007.
- ClinicalTrials.gov. Bethesda (MD): National Library of Medicine (US). Identifier NCT02716116.
- Robichaux JP, Elamin YY, Tan Z, et al. Mechanisms and clinical activity of an EGFR and HER2 exon 20-selective kinase inhibitor in non-small cell lung cancer. Nat Med 2018;24:638-46. [Crossref] [PubMed]
- Heymach J, Negrao M, Robichaux J, et al. OA02.06 A Phase II Trial of Poziotinib in EGFR and HER2 exon 20 Mutant Non-Small Cell Lung Cancer (NSCLC). J Thorac Oncol 2018;13:S323-4. [Crossref]

胡萌
中国人民解放军中部战区总医院肿瘤科。主治医师,医学博士,现任湖北省抗癌协会靶向治疗专委会青年委员,湖北省抗癌协会肿瘤热疗专委会委员,ESCO中西医结合肿瘤专家委员会委员。从事肿瘤内科专业多年,擅长消化系统肿瘤、淋巴瘤等内科诊疗,对肿瘤相关危重症具有一定的临床经验。承担院内课题1项,承担湖北省自然科学基金青年面上项目1项。(更新时间:2021/7/31)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Ge X, Tariq S, Cheng H, Halmos B. Targeting ErbB2 aberrations in non-small cell lung cancer. Precis Cancer Med 2019;2:27.